振奋人心!柳叶刀发布中国首个新冠疫苗I期临床试验安全有效
发布日期:2020-05-26 作者:转自:知识城邦
严重急性呼吸综合征冠状病毒2(SARS-CoV-2,后面简称新冠病毒)于2020年1月首次报道。该病毒在人与人之间具有高度传染性,并迅速传播,导致新冠病毒大流行。感染新冠病毒的患者,特别是老年患者和那些既往合并呼吸或心血管疾病的患者,发生严重并发症的风险很大,包括严重肺炎、急性呼吸窘迫综合征、多器官衰竭,甚至死亡。截止到2020年5月20日,新冠病毒已感染215个国家或地区的470多万人,并导致全世界31.6万人死亡。
在缺乏有效预防措施的情况下,目前控制疫情的最佳管理办法是实施检疫、隔离和保持人与人之间的距离。
因此,全世界都迫切需要一种有效的新冠病毒疫苗,以减少新冠病毒感染及相关死亡带来的巨大负担。全世界有100多种候选疫苗正在开发中,其中至少8种已经开始或即将开始临床试验。
Moderna公司的mRNA冠状病毒疫苗和CanSino公司的非复制型腺病毒5型(Ad5)载体新冠病毒疫苗,均于2020年3月16日进入一期临床试验;
Inovio制药公司的冠状病毒DNA疫苗,于2020年4月3日进入临床试验;
Sinovac、武汉生物制品研究所和北京生物制品研究所生产的三种新冠病毒灭活疫苗,于2020年4月相继投入临床试验;
牛津大学的非复制型冠状病毒疫苗ChAdOx1 nCoV-19,也于最近启动临床试验。
在本研究中,我们中国学者全球首次报道了重组腺病毒5型为载体的新冠病毒疫苗在接种后28天对中国健康成人的安全性、耐受性和免疫原性的初步评估。
重组腺病毒5型为载体的新冠病毒疫苗安全性,耐受性及免疫原性:人类首个剂量递增、开放标签、非随机的新冠疫苗临床试验

Abstract
结论—
以重组腺病毒5型(Ad5)为载体的新冠疫苗接种28天后耐受性和免疫原性良好。健康成人对新冠病毒的体液免疫反应在接种后第28天达到高峰,并在接种后第14天观察到快速的特异性T细胞应答。我们的研究结果表明,Ad5载体新冠疫苗值得进一步研究。
The Ad5 vectored COVID-19 vaccine is tolerable and immunogenic at 28 days post-vaccination. Humoral responses against SARS-CoV-2 peaked at day 28 post-vaccination in healthy adults, and rapid specific T-cell responses were noted from day 14 post-vaccination. Our findings suggest that the Ad5 vectored COVID-19 vaccine warrants further investigation.
— 目的—
目前新冠肺炎全球大流行,迫切需要一种疫苗来预防新冠病毒感染。我们的目的是为了评价表达严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)S株蛋白的重组腺病毒5型(Ad5)载体新型冠状病毒疫苗的安全性、耐受性和免疫原性。
A vaccine to protect against COVID-19 is urgently needed. We aimed to assess the safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 (Ad5) vectored COVID-19 vaccine expressing the spike glycoprotein of a severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) strain.
— 方法—
我们在中国武汉进行了Ad5载体新冠病毒疫苗的剂量递增、单中心、开放标签、非随机的I期临床试验。将18~60岁健康成人分成3个剂量组(5 × 1010、1 × 1011和1·5 × 1011病毒颗粒)进行疫苗肌肉注射。主要研究结果是观察接种疫苗后7天内的不良事件。安全性在接种疫苗28天内进行评估。用ELISA法检测特异性抗体,用SARS-CoV-2病毒中和试验和假病毒中和试验检测疫苗诱导的中和抗体应答。用酶联免疫斑点法和流式细胞仪检测T细胞反应。
这项研究注册在ClinicalTrials.gov,NCT04313127
We did a dose-escalation, single-centre, open-label, non-randomised, phase 1 trial of an Ad5 vectored COVID-19 vaccine in Wuhan, China. Healthy adults aged between 18 and 60 years were sequentially enrolled and allocated to one of three dose groups (5 × 1010, 1 × 1011, and 1·5 × 1011 viral particles) to receive an intramuscular injection of vaccine. The primary outcome was adverse events in the 7 days post-vaccination. Safety was assessed over 28 days post-vaccination. Specific antibodies were measured with ELISA, and the neutralising antibody responses induced by vaccination were detected with SARS-CoV-2 virus neutralisation and pseudovirus neutralisation tests. T-cell responses were assessed by enzyme-linked immunospot and flow-cytometry assays. This study is registered with ClinicalTrials.gov, NCT04313127
— 结果—
在2020年3月16日至3月27日期间,我们对195名志愿者进行了资格筛查。其中108名参与者(男性51%,女性49%;平均年龄36·3岁)接受了低剂量(n=36)、中剂量(n=36)和高剂量(n=36)的疫苗接种。所有登记的参与者都包括在分析中。低剂量组、中剂量组和高剂量组分别有30人(83%)、30人(83%)和27人(75%)在接种疫苗后的前7天内报告了至少一次不良反应。
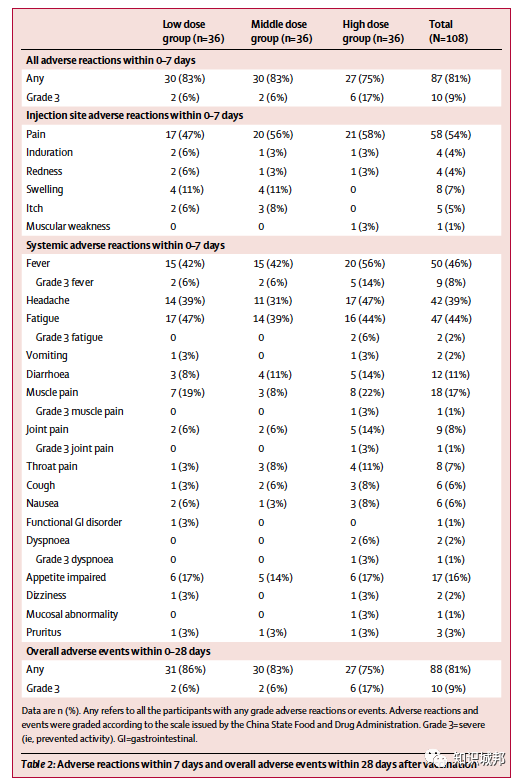
最常见的注射部位不良反应是疼痛,58例(54%)疫苗接种者报告了疼痛。
最常见的全身不良反应包括发热(50例[46%])、乏力(47例[44%])、头痛(42例[39%])和肌肉痛(18例[17%])。
所有剂量组报告的大多数不良反应都属于中度不良反应。接种后28天内未发现严重不良事件。
ELISA抗体和中和抗体在接种后第14天显著升高,并在接种后第28天达到高峰。特异性T细胞应答在接种后第14天达到高峰。
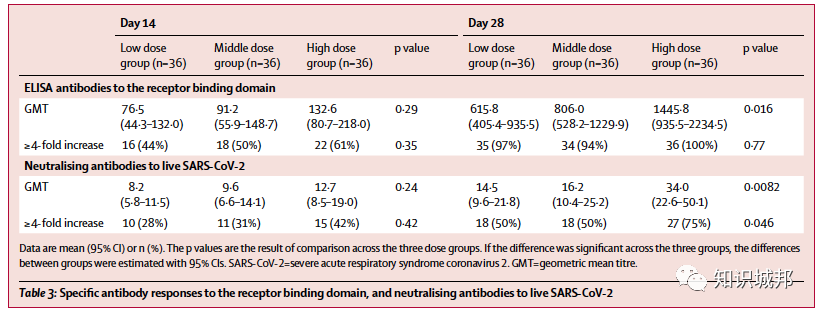
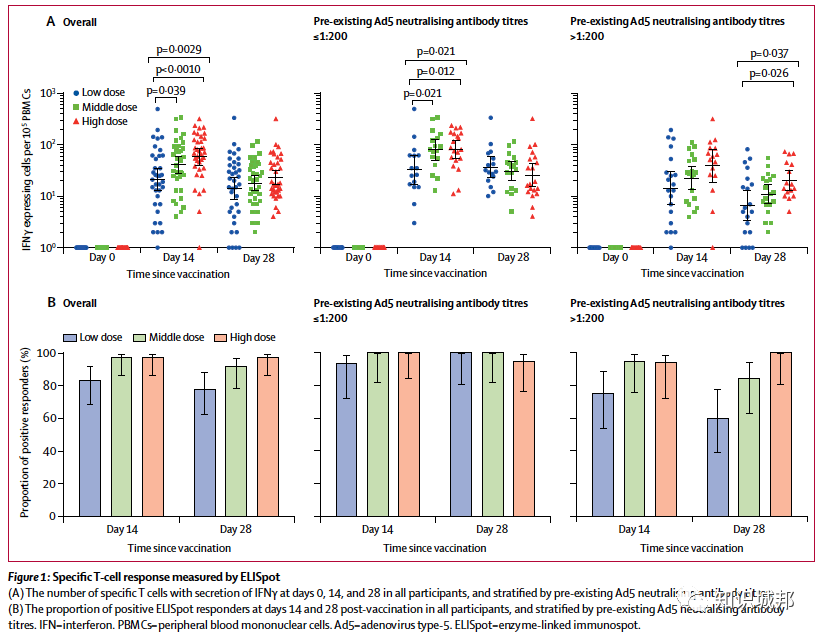
Between March 16 and March 27, 2020, we screened 195 individuals for eligibility. Of them, 108 participants (51% male, 49% female; mean age 36·3 years) were recruited and received the low dose (n=36), middle dose (n=36), or high dose (n=36) of the vaccine. All enrolled participants were included in the analysis. At least one adverse reaction within the first 7 days after the vaccination was reported in 30 (83%) participants in the low dose group, 30 (83%) participants in the middle dose group, and 27 (75%) participants in the high dose group. The most common injection site adverse reaction was pain, which was reported in 58 (54%) vaccine recipients, and the most commonly reported systematic adverse reactions were fever (50 [46%]), fatigue (47 [44%]), headache (42 [39%]), and muscle pain (18 [17%]. Most adverse reactions that were reported in all dose groups were mild or moderate in severity. No serious adverse event was noted within 28 days post-vaccination. ELISA antibodies and neutralising antibodies increased significantly at day 14, and peaked 28 days post-vaccination. Specific T-cell response peaked at day 14 post-vaccination.
— 讨论—
结果确实很令人振奋,正如柳叶刀主编Richard Horton所说:“These results respresent in important milestone."(这些结果代表着一个重要的里程碑)
当然,疫苗的研究与开发是一个漫长而又艰辛的过程,我们目前的结果还是I期临床试验,后续的道路还很漫长。这些试验的最终结果还将在6个月内进一步评估。
自豪的是,据本研究通讯作者陈薇院士此前介绍,该重组新冠疫苗已于4月12日启动II期临床试验,508个志愿者已经注射完毕,目前正处于观察期,如果一切顺利,将于5月份揭盲。